ΤΙ ΠΡΕΠΕΙ ΝΑ ΓΝΩΡΙΖΟΥΜΕ ΓΙΑ ΤΙΣ ΜΠΑΤΑΡΙΕΣ
Η μπαταρία είναι ένα από τα βασικά εξαρτήματα σε όλων των ειδών τα οχήματα, σκάφη και μηχανήματα, καθώς και η πηγή ενέργειας πολλών ηλεκτρικών συσκευών.
Υπολογίζεται ότι πάνω από 130 εκατομμύρια μπαταρίες είναι εγκατεστημένες μόνο σε οχήματα και σκάφη.
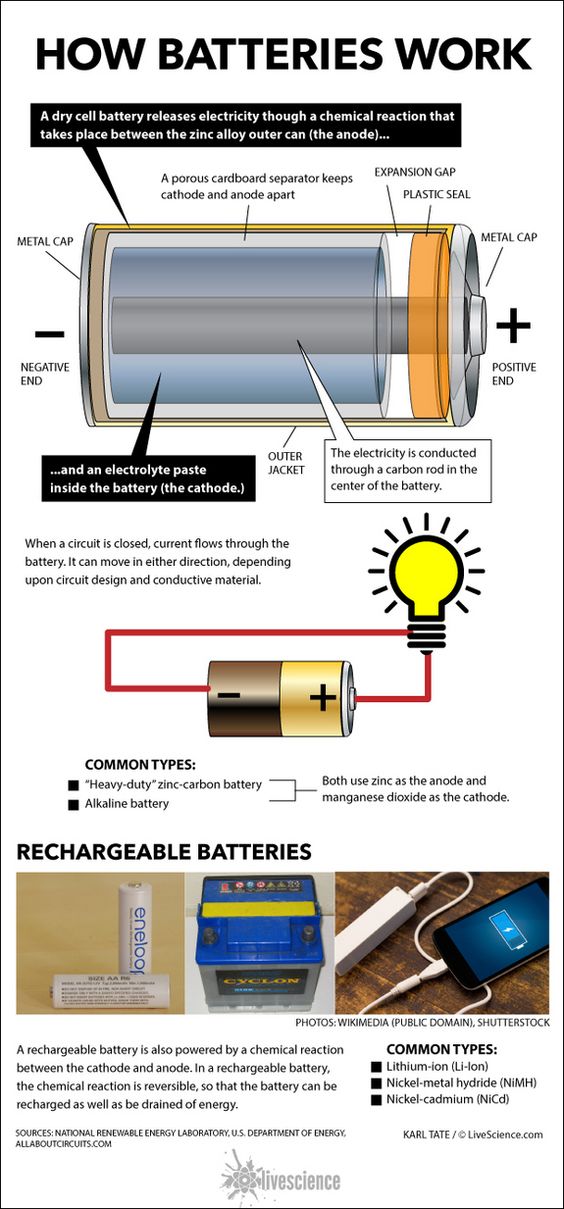
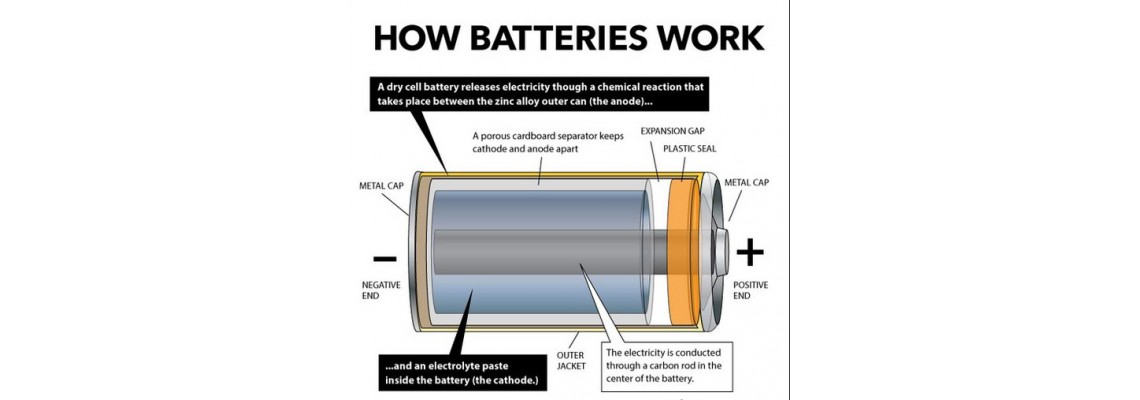
Τι είναι και Πώς δουλεύει μια μπαταρία
Η μπαταρία είναι μια αποθήκη ηλεκτρικής ενέργειας.
Στην ουσία είναι μια δεξαμενή γεμάτη χημικά που παράγει ηλεκτρόνια, και κατ’ επέκταση μας παρέχει ηλεκτρική ενέργεια.
Είναι δηλαδή μια διάταξη που μετατρέπει τη χημική ενέργεια σε ηλεκτρική.
Η χημεία της μπαταρίας
Η πρώτη μπαταρία κατασκευάστηκε από τον Alessantro Volta το 1800 και αποτελούνταν από στρώσεις ψευδάργυρου, στυπόχαρτου εμβαπτισμένου σε κορεσμένο αλμυρό νερό και άργυρο.
Αυτή η στοίβα, με διαφορετικά μέταλλα σε κάθε άκρο της, δημιουργούσε μία ηλεκτρική στήλη που ανάλογα με τις στρώσεις έδινε και την αντίστοιχη τάση.
Κάθε μπαταρία αποτελείται εξωτερικά από δύο πόλους.
Έναν Θετικό (+) και έναν Αρνητικό (-) με τα ηλεκτρόνια να είναι μαζεμένα στον αρνητικό πόλο και να ρέουν προς το θετικό όταν συνδέουμε σε αυτούς ένα φορτίο (π.χ. μια λάμπα, ένα μοτέρ κλπ).
Εσωτερικά έχουμε μια χημική αντίδραση που παράγει τα ηλεκτρόνια.
Η ταχύτητα παραγωγής ηλεκτρονίων από τη χημική αντίδραση καθορίζει πόσα ηλεκτρόνια μπορούν να ρέουν μεταξύ των πόλων.
Τύποι μπαταριών
-
Ψευδαργύρου – Άνθρακα (Zinc-Carbon):
Οι απλές μπαταρίες που χρησιμοποιούμε στις ηλεκτρικές συσκευές, με ηλεκτρολύτη μια πάστα όξινη.
-
Αλκαλικές (Alkaline):
Τα ηλεκτρόδια είναι ψευδάργυρος και οξείδιο μαγνησίου με αλκαλικό καταλύτη.
-
Λιθίου (Lithium):
Τα ηλεκτρόδια είναι λίθιο και ιωδιούχο λίθιο με ηλεκτρολύτη ιωδιούχο μόλυβδο.
-
Μολύβδου (Lead-Acid):
Τα ηλεκτρόδια είναι μόλυβδος και οξείδιο μολύβδου με ηλεκτρολύτη διάλυμα θειικού οξέως (επαναφορτιζόμενη).
-
Νικελίου-Καδμίου (Nickel-Cadmium):
Τα ηλεκτρόδια είναι υδροξείδιο νικελίου με κάδμιο και ηλεκτρολύτη υδροξείδιο καλίου (επαναφορτιζόμενη).
-
Νικελίου-Υδριδίου Μετάλλου (Nickel-Metal Hydride):
Τα ηλεκτρόδια είναι υδροξείδιο νικελίου με υδρίδιο μετάλλου και τείνουν να αντικαταστήσουν τις Νικελίου-Καδμίου καθώς δεν παρουσιάζουν έντονο φαινόμενο μνήμης (επαναφορτιζόμενη).
-
Ιόντων Λιθίου (Lithium-Ion):
(επαναφορτιζόμενη)
-
Μπαταρίες για ειδικές χρήσεις, ψευδαργύρου-αέρος, ψευδαργύρου-υδραργύρου, αργύρου-ψευδαργύρου κλπ.
Σύνδεση μπαταριών και χωρητικότητα
Οι μπαταρίες και τα στοιχεία μπορούν να συνδεθούν παράλληλα ή σε σειρά.
Οι μπαταρίες πρέπει να είναι ίδιες, να έχουν ίδια τάση και χωρητικότητα, καθώς και -αν είναι δυνατόν- να βρίσκονται στην ίδια κατάσταση (δεν χρησιμοποιούμε μια παλιά με μια καινούργια).
Η χωρητικότητα μιας μπαταρίας εκφράζεται σε μιλιαμπερώρια (mAmph) ή αμπερώρια (Amph), ανάλογα με το μέγεθος, και είναι η ένταση του ρεύματος που μπορεί να δώσει σε mAmp ή Amp αντίστοιχα για μια ώρα συνεχώς.
Τα μεγέθη αυτά είναι αναλογικά. Αν έχουμε δηλαδή μια μπαταρία 10Amph αυτή μας δίνει 10Α για μια ώρα, 1Α για 10 ώρες, 100mA για 100 ώρες, 20Α για μισή ώρα και θεωρητικά 100Α για 6 λεπτά ή 1000Α για 36 δευτερόλεπτα.
Αυτά ωστόσο είναι θεωρητικά, γιατί δεν μπορούμε να έχουμε τέτοιας εντάσεως ρεύματα γι’ αυτού του μεγέθους τη μπαταρία, καθώς η εκφόρτιση μιας μπαταρίας δεν είναι γραμμική.
Κάθε μπαταρία έχει ένα μέγιστο ρεύμα που μπορεί να δώσει, καθώς δεν μπορεί η χημική αντίδραση να γίνει τόσο γρήγορα ώστε να προκύψουν τα απαραίτητα ηλεκτρόνια.
Επίσης, όσο μεγαλώνει το ρεύμα τόσο μεγαλώνει και η παραγόμενη θερμότητα μειώνοντας έτσι την ισχύ της μπαταρίας.
Σαν μέγεθος όμως η χωρητικότητα μιας μπαταρίας, ειδικά για μπαταρίες ηλεκτρικών συσκευών, μας δείχνει εύκολα τι καταναλώσεις μπορούμε να πάρουμε και για πόσο χρόνο, μέσα στα πλαίσια πάντα των δυνατοτήτων της.









































